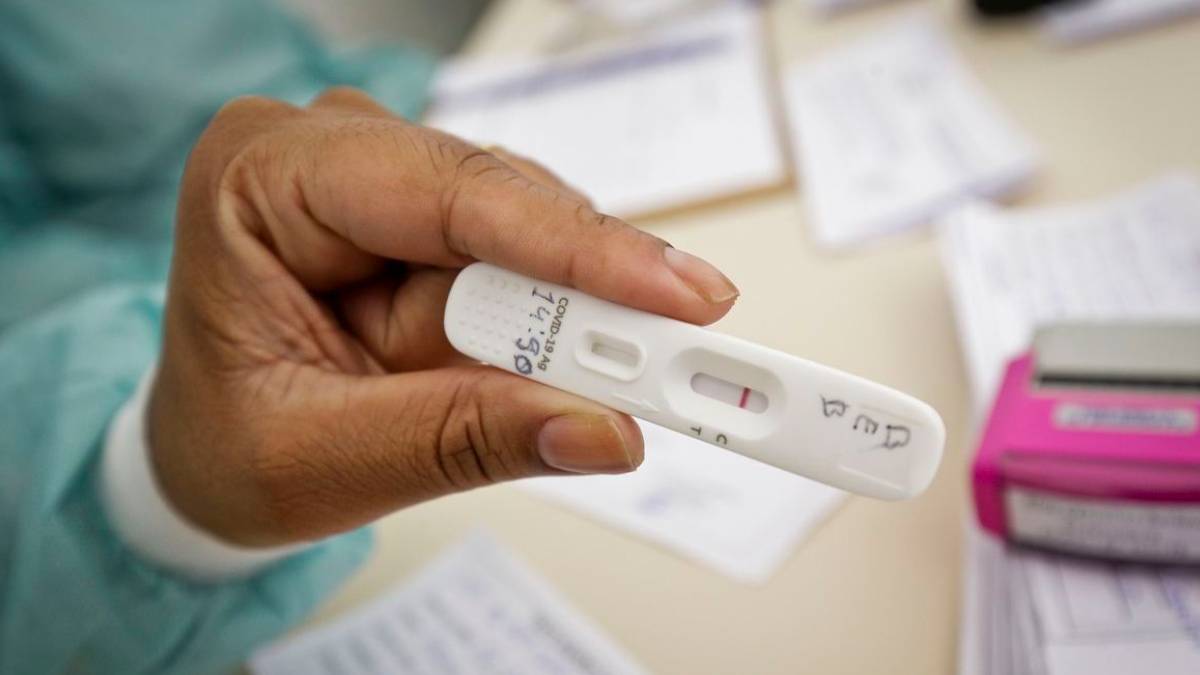
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou, nesta sexta-feira (28), o uso e a comercialização de autotestes para detecção de Covid-19 no Brasil. A decisão da diretoria colegiada da agência foi unânime. Agora, a Anvisa vai publicar uma resolução com as orientações e requisitos para as empresas interessadas na venda dos testes.
Há pouco mais de uma semana, a Anvisa já havia solicitado ao Ministério da Saúde esclarecimentos sobre a inclusão do autoteste nas políticas públicas de testagem para a Covid-19. Na ocasião, a agência também fez questionamentos sobre o registro de casos positivos e o ministro da Saúde, Marcelo Queiroga, já havia afirmado que o autoteste poderia “se somar ao esforço do poder público” (veja aqui).
Quando estará disponível?
Com a decisão desta sexta, a agência vai publicar uma resolução detalhando os requisitos necessários para que as empresas interessadas na comercialização dos autotestes em farmácias peçam o registro dos produtos. Isso significa que ainda vai levar um tempo até que os testes estejam disponíveis para o público.
Esse tempo é parte da fiscalização, já que, para que cheguem às prateleiras das farmácias, cada produto – de cada fabricante ou importador – deve ainda ser aprovado individualmente pela Anvisa, após análise de documentação.
É de graça?
A aprovação do autoteste ocorreu depois de o Ministério da Saúde incluir um capítulo sobre o assunto no Plano Nacional de Expansão da Testagem para Covid-19. Acerca do registro de casos positivos, foi considerado suficiente exigir que os fabricantes dos produtos disponibilizem plataforma para tal, por meio de tecnologia QR Code.
A faixa de preços dos autotestes ainda não foi determinada no Brasil, mas, ainda nessa quinta-feira (27), o ministro da Saúde afirmou que os produtos não devem ser disponibilizados pelo SUS (Sistema Único de Saúde). Segundo Queiroga, a ideia é que os autotestes estejam disponíveis em farmácias para quem “tiver interesse em adquirir”.
Mesmo assim, todos os diretores que participaram da votação (veja abaixo) demonstraram preocupação com o preço do autoteste. Eles destacaram que, para serem acessíveis ao maior número possível de pessoas, os preços dos produtos devem ser menores do que os praticados atualmente, tendo em vista que dispensam o fornecimento do serviço de coleta do material biológico.
“Não há competência legal da Anvisa para estabelecer preços máximos. Contudo, entendo que é fundamental que os órgãos de proteção e defesa do consumidor continuem a realizar ações para coibir práticas de mercado que podem ser consideradas abusivas”, disse o diretor Rômison Rodrigues Mota.
Requisitos
Um dos requisitos para aprovação de cada produto, de acordo com o voto da relatora do tema na Anvisa, diretora Cristiane Rose Jourdan Gomes, é que os autotestes tragam informações, com linguagem clara e precisa, orientando o público leigo sobre como colher adequadamente o material biológico e fazer o exame.
Além disso, a agência também determina que os produtos devem ter sensibilidade de 80% ou mais ao coronavírus e que possuam especificidade de no mínimo 97% na detecção do vírus, de acordo com o voto da relatora.
‘Medida adicional’
“Não resta dúvida de que o produto do diagnóstico in vitro na forma de autoteste pode sim representar excelente estratégia de triagem e medida adicional no controle da pandemia. Principalmente neste momento em que o contágio pela doença é grande e muitas pessoas não conseguem ter acesso aos testes pelo SUS ou por laboratórios da rede privada”, frisou a relatora do tema na Anvisa.
Cristiane Gomes ainda citou exemplos de outros países, como Alemanha, Estados Unidos e Reino Unido, onde os autotestes – muitas vezes disponibilizados gratuitamente – têm sido essenciais para o monitoramento e controle da pandemia.
O voto dela foi seguido pelos demais diretores que participaram da reunião extraordinária desta sexta-feira – Rômison Rodrigues Mota, Alex Machado e Meiruze de Souza Freitas. O diretor-presidente da Anvisa, Antonio Barra Torres, não participou, por motivo de emergência de saúde na família.
Em seu voto, o diretor Rômison Rodrigues Mota disse que “o autoteste tem excelente aplicabilidade no contexto pandêmico, visto que permite o isolamento precoce de casos positivos e a quebra de cadeia de transmissão da Covid-19”.
Ele destacou ainda dados da Abrafarma (Associação Brasileira de Redes de Farmácias e Drogarias), divulgados ontem, dando conta de altíssima demanda por testagem para Covid-19. Segundo a entidade, entre 17 e 23 de janeiro, foram feitos um recorde de 740,7 mil testes em farmácias e drogarias, sendo que 43,14% resultaram positivos.
Com Agência Brasil


